Pedro Andrade, investigador no BIOPOLIS-CIBIO (Universidade do Porto), conta-nos uma história que mostra como a ciência está sempre a evoluir e como os mais pequenos podem ser igualmente valiosos, quando se trata de desvendar um enigma natural.
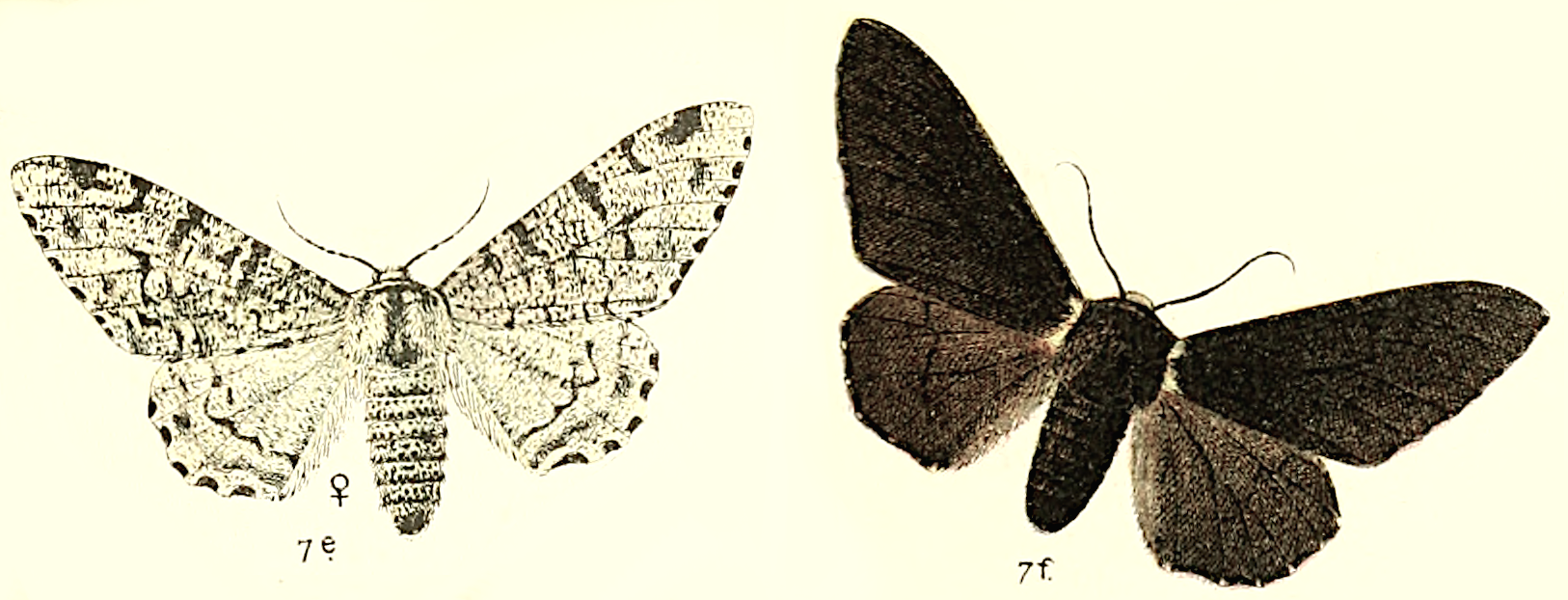
Uma das consequências mais conhecidas da Revolução Industrial do século XVIII foi o grande aumento nos níveis de poluição atmosférica. No coração da Inglaterra industrial desta época, muitas árvores ficaram cobertas por uma camada de fuligem negra. Para algumas borboletas noturnas que evoluíram durante milhões de anos para mimetizarem os troncos brancos das bétulas, a salvação foi o aparecimento de mutações genéticas que induziam o aumento da produção de melanina nas suas asas. Este pigmento escuro permitiu a evolução de uma nova forma de camuflagem na paisagem poluída.
O caso mais conhecido é o da espécie Biston betularia, um exemplo contemporâneo de evolução por seleção natural. Embora já seja um caso de estudo clássico em livros escolares, só na última década é que se descobriu a mutação genética responsável pelo aparecimento das formas escuras desta borboleta noturna: um fragmento de DNA “parasítico” (semelhante a um exemplo que já discutimos sobre borboletas brancas e amarelas) que parece alterar o funcionamento de um gene chamado cortex.
Desde esta descoberta, vários estudos demonstraram que este gene parece estar associado, de alguma forma, a diferenças na cor das escamas das asas em muitas outras espécies de borboletas (incluindo espécies noturnas e diurnas, muito distintas entre si). O gene cortex parece ser um dos reguladores-mestre da cor destes insetos.
Nesses estudos, quando comparam a informação genética de borboletas com cores distintas, os investigadores encontram evidências de diferenças genéticas elevadas perto deste gene.
No entanto, diferentes investigadores têm tido dificuldades em explicar os resultados de algumas experiências laboratoriais. Por exemplo, durante o desenvolvimento da asa, este gene parece estar ativo de forma ubíqua nas células que irão dar origem às pequenas escamas que a compõem, independentemente da sua cor. Em espécies com secções das asas claras e escuras, estaríamos à espera que este gene estivesse ativo de forma diferente em secções com diferentes cores, durante o desenvolvimento da asa, replicando o que seriam os padrões de melanização da asa na borboleta adulta, mas isto não se verifica. Poderemos estar perante o caso de um gene com identidade trocada?
Nem todos os genes funcionam da mesma forma
Como falámos em artigos anteriores, as moléculas de DNA (ácido desoxirribonucleico) que se encontram no interior das nossas células são constituídas por uma sequência de quatro elementos básicos (as quatro “letras” A, C, G e T). Quando ordenados de uma determinada forma, fornecem à célula um guião para o seu funcionamento, como um livro de receitas.
A leitura desta receita é feita, normalmente, da seguinte forma: quando a célula precisa de “ler a receita” (o DNA), trata de transcrever a informação de cada gene (o ingrediente) para uma nova molécula semelhante à qual se dá o nome de RNA (ácido ribonucleico). É um pouco como se pegássemos numa folha de rascunho para copiar a receita, de forma temporária. O RNA (a folha de rascunho) é depois utilizado para produzir a proteína.

A maior parte dos animais funciona em grande parte devido à interação entre cerca de 20 mil genes que codificam proteínas, mas ainda há muito por descobrir. Afinal de contas, foi apenas há 25 anos que se descodificou pela primeira vez a sequência do genoma humano.
E em cada pessoa, para além de cerca de 20 mil genes, estimam-se ainda que possam existir mais 30 mil genes que, contrariamente à função normal de produzir uma proteína, ficam a meio caminho do processo e apenas produzem RNA. 30 mil “folhas de rascunho” que não dão em nada? Ou que podem ser também usadas pela célula para pôr toda esta maquinaria a funcionar?
Instruções vitais num pequeno post-it
Em muitos daqueles estudos com genomas de borboletas coloridas, o sinal de diferenciação estava associado a um só segmento da sequência genética, e nesse segmento conhece-se apenas um gene que produz proteínas: cortex. Assim, o cortex tornou-se o candidato ideal para explicar as diferenças de cor. Mas afinal de contas, só existe o cortex naquele segmento do genoma das borboletas?
Numa nova série de descobertas partilhadas este ano por vários investigadores, incluindo pelo grupo liderado pela portuguesa Antónia Monteiro (da Universidade Nacional de Singapura), tentou-se perceber o que é que, afinal de contas, existe naquele segmento que controla a cor das borboletas. Para além do gene cortex, aquele segmento do “livro de receitas” possui pelo menos mais dois pequenos ingredientes – não genes que codificam proteínas, mas sim dois pequeninos pedaços de informação genética que codificam microRNAs – “folhas de rascunhos” muito pequeninas com menos de 25 letras, meros post-its quando comparados com o importante cortex ao lado deles. Para comparação, a maior parte dos genes geram moléculas de RNA constituídas por centenas ou milhares de letras cada.
Significa isto que estas pequenas instruções não servem para nada? Através de uma série de experiências nas quais cancelaram a sua função durante o desenvolvimento de borboletas em laboratório, e avaliaram o resultado de seguida, perceberam que um desses post-its, com o estranho nome mir-193, conseguia explicar muito bem as diferenças de cor.

De facto, borboletas nas quais este pequeno post-it não é utilizado têm asas muito mais claras. Experiências semelhantes foram feitas em várias espécies de borboletas, com o mir-193 ou com a sua molécula percursora, que demonstram a sua importância para o desenvolvimento da cor. Em vez de gerar uma proteína como os genes “normais”, o mir-193 provavelmente interage com outras moléculas de RNA, intervindo a meio do processo de funcionamento de outros genes que produzem melanina para regular a sua atividade.
Numa demonstração adicional da importância desta função, os investigadores descobriram que este microRNA também controla a pigmentação em moscas. O último antepassado comum entre as moscas e as borboletas viveu há quase 300 milhões de anos, bem antes dos primeiros dinossauros, por isso por muito pequeno que seja este fragmento de DNA, é bem possível que tenha controlado a evolução das cores de muitos insetos ao longo de milhões de anos.
E quanto ao cortex, será um caso de “o rei vai nu”? Nem por isso. Apesar do seu conhecido papel na determinação da cor das borboletas não parecer ser real, recordemos que este gene expressa-se um pouco por toda a asa em desenvolvimento em cada borboleta. Estudos mais antigos com moscas sugerem uma função durante a divisão celular, por isso o seu papel poderá até ser mais importante do que a produção de cor, se bem que menos evidente aos nossos olhos.
Histórias como a da identidade trocada de um dos genes mais importantes para a cor das borboletas ensinam-nos duas coisas. Por um lado, recordam-nos como a ciência se encontra sempre em evolução, e como há sempre coisas a descobrir mesmo quando as respostas já existiam à nossa frente. Por outro, mostram como não devemos descontar a importância dos pequeninos e discretos quando andamos à procura de suspeitos nos nossos mistérios naturais.
Referências
Hof, A. E. V. T., Campagne, P., Rigden, D. J., Yung, C. J., Lingley, J., Quail, M. A., … & Saccheri, I. J. (2016). The industrial melanism mutation in British peppered moths is a transposable element. Nature, 534(7605), 102-105.
Livraghi, L., Hanly, J. J., Evans, E., Wright, C. J., Loh, L. S., Mazo-Vargas, A., … & Martin, A. (2024). A long non-coding RNA at the cortex locus controls adaptive colouration in butterflies. bioRxiv, 2024-02.
Nadeau, N. J., Pardo-Diaz, C., Whibley, A., Supple, M. A., Saenko, S. V., Wallbank, R. W., … & Jiggins, C. D. (2016). The gene cortex controls mimicry and crypsis in butterflies and moths. Nature, 534(7605), 106-110.
Pesin, J. A., & Orr-Weaver, T. L. (2007). Developmental role and regulation of cortex, a meiosis-specific anaphase-promoting complex/cyclosome activator. PLoS Genetics, 3(11), e202.
Tian, S., Asano, Y., Banerjee, T. D., Wee, J. L. Q., Lamb, A., Wang, Y., Murugesan, S. N., Ui-Tei, K., Wittkopp, P. J., & Monteiro, A. (2024). A micro-RNA is the effector gene of a classic evolutionary hotspot locus. bioRxiv, 2024-04.
A série “Está nos genes”, sobre a genética da vida selvagem, é da autoria de Pedro Andrade, investigador em biologia evolutiva no BIOPOLIS-CIBIO – Centro de Investigação em Biodiversidade e Recursos Genéticos, onde estuda a evolução e genética de animais selvagens e domésticos. Descubra aqui mais artigos deste cientista.













